生物化學與分子生物學/參考:蛋白質一級結構的測定方法
| 醫學電子書 >> 《生物化學與分子生物學》 >> 蛋白質化學 >> 參考:蛋白質一級結構的測定方法 |
| 生物化學與分子生物學 |
|
|
|
蛋白質一級結構的測定方法
研究蛋白質的一級結構從確定組成蛋白質的單元結構棗氨基酸算起,已有150年的悠久歷史,直到1955年,Sanger首次闡明胰島素的氨基酸排列順序,為研究蛋白質的一級結構開辟了道路。這在分子生物學的發展進程中是一個重要突破。目前關于核酸的一級結構研究,由于Sanger等發明了加減法,可以得到了突飛猛進的發展。對此之下,關于蛋白質的一級結構研究進展不如核酸迅速。但隨著Edman液相自動順序分析儀和固相順序分析儀以及氣相色譜質譜(GCMS)等方法的相繼出現。使結構分析的速度也顯著加快。至今已完成近千種蛋白質的一級結構分析。目前不僅樣品用量減少,而且工作人員也大大減少。當年Sanger分析胰島素用了整整十年的時間,今天運用自動化儀器,分析一個分子量在10萬左右的蛋白質只需要幾天,可見新技術的應用和發展對科學發展起的促進作用,蛋白質一級結構測定方法的綜述及專著文獻較多,這里只扼要加以概述。
蛋白質分子的一級結構測定,概括起來包含多肽鏈的分離、降解、肽段的分離和順序分析以及-S-S-定位等。
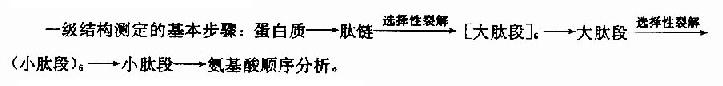
一級結構的測定方法可概述如下:
1.多肽鏈的分離
在測定一個蛋白質的結構以前,首先必須保證被測蛋白質的純度,使結果準確可靠。其次要了解它的分子量和亞基數,按照其亞基數將蛋白質分成幾個多肽鏈。
1)肽鏈的拆開
蛋白質分子多肽鏈的連接有共價結合和非共價結合兩種。要拆開以共價結合的-S-S-連接的多肽鏈,必須采用的化學處理方法常有:
①過甲酸氧化
用氧化劑過甲酸斷裂-S-S-。這個反應一般在0℃下進行2小時左右,兩個S就全部能轉變成磺酸基,這樣被氧化的半胱氨酸稱為磺基丙氨酸。
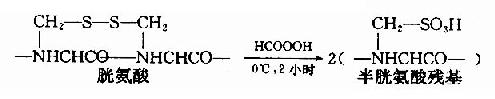
如果蛋白質分子中同時存在半胱胺酸,那么也會被氧化成磺基丙氨酸。此外甲硫氨酸和色氨酸也可被氧化,從而增加分析的復雜性。
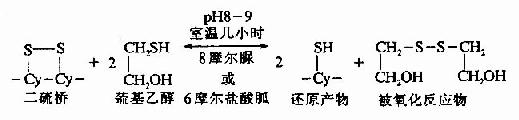
利用還原劑巰基乙醇亦可使蛋白質的-S-S-斷裂。當高濃度的巰基乙醇在pH8?條件下室溫保溫幾小時后,可以使-S-S-定量還原為桽H。與此同時反應系統中還需要有8摩爾脲或6摩爾鹽酸胍使蛋白質變性,多肽鏈松散成為無規則的構型,此時還原劑就可作用于-S-S-。此反應是可逆的,因此要使反應完全,疏基乙醇的濃度必需在0.1-0.5摩爾。
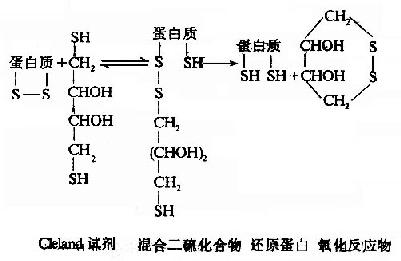
③Cleland試劑的還原作用
Cleland′s指出二硫赤蘇糖醇(dithioerythriotol)及二硫蘇糖醇(dithiothriotol)在氧化還原能力上是比較強的試劑,只要0.01摩爾就能使蛋白質的-S-S-還原,反應基本與疏基乙醇相似,且在許多球蛋白反應中,可以不用變性劑。
Cleland試劑首先與蛋白質-S-S-形成中間物,反應終了,還原劑被氧化形成一個穩定的六環化合物,蛋白質則被還原。
還原蛋白不穩定,SH基極易氧化重新生成-S-S-鍵。穩定SH基的方法有:
(A)烷基化試劑使SH基轉變為穩定的硫醚衍生物。
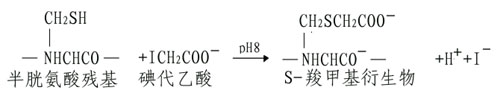
如果碘代乙酰胺代替碘代乙酸,其產物S羧氨甲基衍生物不帶電荷,磺代乙酸也可與組氨酸、蛋氨酸和賴氨酸發生反應,但反應條件不同,可通過各種pH及反應時間進行控制。
(B)氨乙基化
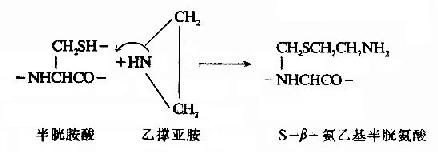
蛋白質分子的幾條肽鏈若以非共價健結合,則用尿素、鹽酸胍等變性劑即可拆開。蛋白質的多肽鏈被拆開后,將它分離純化,一般多用凝膠過濾、離子交換、電泳等方法,茲不贅述。
分離純化后的每條肽鏈還要進一步分析其末端。
2)末端分析 其方法較多,這里我們只介紹較常用的幾種。
(1)N-末端測定
A.二硝基氟苯法(FDNB,DNFB):1945年Sanger提出此方法,是他的重要貢獻之一。
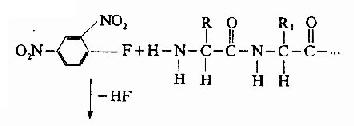
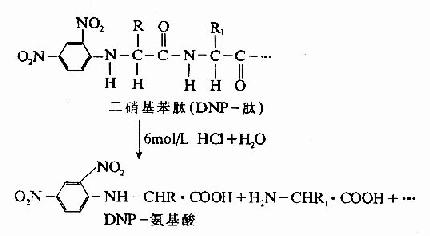
DNP-氨基酸用有機溶劑抽提后,通過層析位置可鑒定它是何種氨基酸。Sanger用此方法測定了胰島素的N末端分別為甘氨酸及苯丙氨酸。
B.氰酸鹽法:1963年Stank及Smyth介紹了一種測定N末端的新方法,步驟如下:
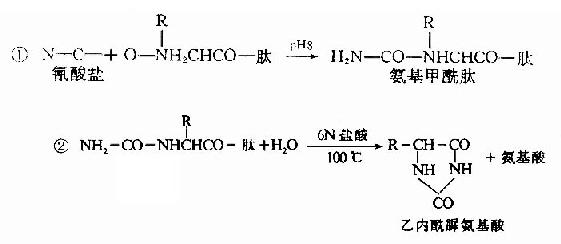
由于乙內酰脲氨基酸不帶電荷,因此可用離子交換層析法將它與游離氨基酸分開,分離所得的乙內酰脲氨基酸再被鹽酸水解,重新生成游離的氨基酸,鑒別此氨基酸即可了解N-末端是何種氨基酸。
C.二甲基氨基萘磺酰氯法:1956年Hartley等報告了一種測定N-末端的靈敏方法,采用1-二甲基氨基萘-5-磺酰氯,簡稱丹磺酰氯。它與游離氨基末端作用,方法類似于Sanger的DNFB法,產物是磺酰胺衍生物。
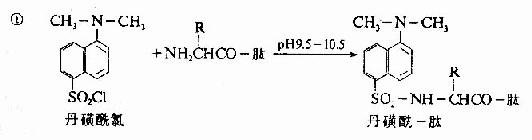
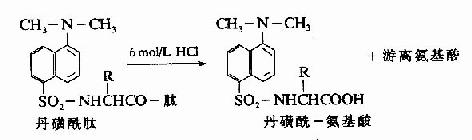
丹磺酰鏈酸具有強烈的黃色熒光。此法優點為靈敏性較高(比FDNB法提高100倍,樣品量小于1毫微克分子)及丹磺酰氨基酸穩定性較高(對酸水解穩定性較DNP氨基酸高),可用紙電泳或聚酰胺薄膜層析鑒定。
(2)C-末端分析
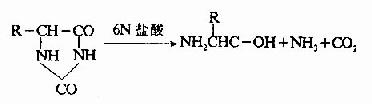
A.肼解法:這是測定C-末端最常用的方法。將多肽溶于無水肼中,100℃下進行反應,結果羧基末端氨基酸以游離氨基酸狀釋放,而其余肽鏈部分與肼生成氨基酸肼。
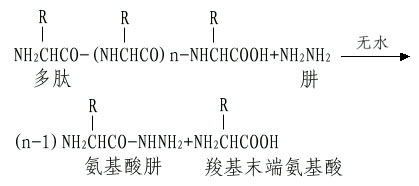
這樣羧基末端氨基酸可以采用抽提或離子交換層析的方法將其分出而進行分析。如果羧基末端氨基酸側鏈是帶有酰胺如天冬酰胺和谷氨酰胺,則肼解時不能產生游離的羧基末端氨基酸。此外肼解時注意避免任何少量的水解,以免釋出的氨基酸混淆末端分析。
B.羧肽酶水解法:羧肽酶可以專一性地水解羧基末端氨基酸。根據酶解的專一性不同,可區分為羧肽酶A、B和C。應用羧肽酶測定末端時,需要事先進行酶的動力學實驗,以便選擇合適的酶濃度及反應時間,使釋放出的氨基酸主要是C末端氨基酸。
3)氨基酸組成分析
在進一步分析多肽鏈的氨基酸順序之前,首先應了解它是由那幾種氨基酸組成的,每種氨基酸有多少?分析組成的方法有:
①層析法
將多肽鏈完全酸水解成游離氨基酸,然后進行Dansyl標記,聚酰胺薄膜層析,此方法在蛋白質結構分析中是一種超微量的分析術,但此方法用于定量分析尚不夠準確。
②離子交換層析法
Spaekman等發展了一種精確的氨基酸組分的定量方法。他們采用磺酸型的離子交換樹脂,這是一種高分子量的固體聚苯乙烯,帶有大量的功能基團,磺酸基在低pH和低離子強度條件下,根據氨基酸的酸堿性,氨基酸帶正電,于是替換下樹脂上的Na+,借助靜電作用而結合到磺酸基上。
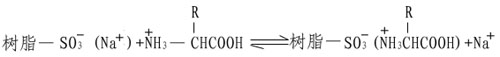
由于各種氨基酸在樹脂上的親和力不同,因此當改變溶液pH和離子強度,便可依次將它們洗脫下來而分開,并進行定量測定。在此基礎上發展了氨基酸自動分析儀。隨著科學技術的日益進展,氨基酸自動分析儀在樣品的用量,分離速度及檢測能力上也有了很大的提高。目前最好的儀器樣品分析量只要幾十Picomole,分析時間只要數十分鐘,而且計算全部自動化,給研究蛋白質一級結構帶來了極大的方便。
2.多肽鏈的降解
多肽鏈的氨基酸組成往往是比較復雜,因此直接分析多肽的氨基酸順序還是很困難的,多采用將多肽鏈進一步降解成為更小的片段,然后再行分析。肽鍵的裂解是一級結構研究工作中的重要問題,它要求裂解點少,選擇性強,而且反應產率高,目前主要有化學法和酶解法兩類。
1)化學法
(1)溴化氰法 是最理想的化學方法,能選擇性斷裂甲硫氨酸所在的肽鍵
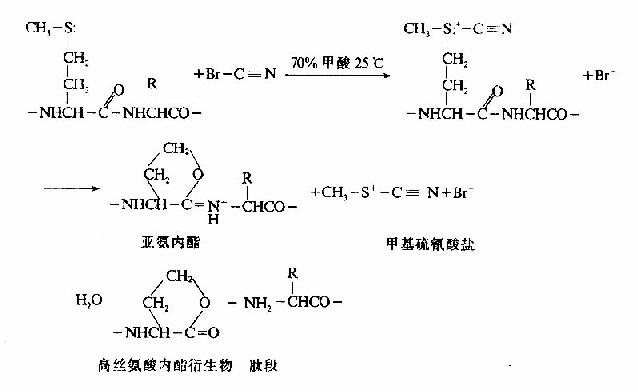
溴化氫化學降解法其優點:
①一般蛋白質含甲硫氨酸較少,由此可獲得大片段
②專一性強
③產率高達80%以上
④作用條件溫和,在室溫中用幾到十幾小時即可。
(2)部分酸水解法
Sanger在分析胰島素的一級結構中采用了此法,即用0.1N鹽酸在110℃或用6N鹽酸在37℃水解。這種部分酸水解的方法特異性不強,因此對大片段的蛋白質和肽均不合適。
(3)羥胺法
這種方法近十年來開始受人注意,羥胺能專一性地裂解AsnGly的肽鍵,酸性條件下裂解Asn-Pro肽鍵。已用于某些蛋白質的分析。
主要裂解Try處的肽鍵,五十年代研究較多。但由于它也能斷裂TyrHis肽鍵,因此應用不廣。
2)酶解法
酶水解法較化學法具有更多的優越性,使用也更廣泛。因其具有較高專一性,而且水解產率較高,所以可以選擇各種不同專一性的酶進行專一性的斷裂。
胰蛋白酶專一斷裂Lys,Arg的羧基側肽鍵,如果對Lys,Arg,CysH進行化學修飾可改變胰蛋白酶的斷裂性質。
(1)賴氨酸的修飾。將Lys用順丁烯二酸酐或甲基順丁烯二酸桿修飾,則胰蛋白酶僅使Arg肽鍵斷裂。
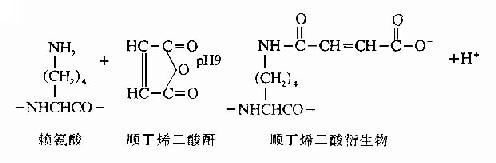
順丁烯衍生物在中性pH下穩定,胰蛋白酶水解僅使Arg鍵斷裂。在酸性條件下順丁烯衍生物可脫去封閉,此時再行胰蛋白酶水解,則得賴氨酸為末端的多肽。下述為蛋白質中的賴氨酸,經順丁烯酰化作用后,被胰蛋白酶水解的例子。
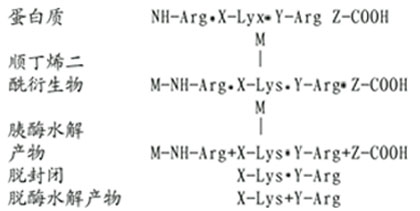
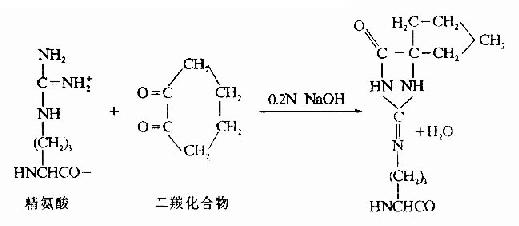
(2)精氨酸的修飾。精氨酸與1,2-和1,3-二羰化合物作用,縮合產物是一雜環化合物,十分穩定。然后胰酶水解僅斷裂賴氨酸殘基末端的肽鍵
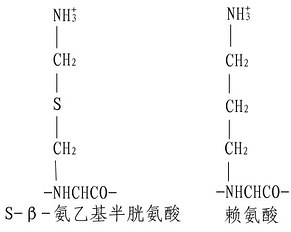
(3)半胱氨酸的修飾。若肽鏈內Lys、Arg均較少,則為了增加胰酶的裂解點,可以將半胱氨酸進行氨乙基化,其產物Sβ氨乙基半胱氨酸有類似Lys的結構,胰蛋白酶在水解時,不能識別這微細的變化,從而在半胱氨酸處斷裂。
蛋白水解酶的專一性
| 酶 | 米源 | 主要作用點 | 其它作用點 |
| 胰蛋白酶 | 胰 | Arg,Lys | |
| 糜蛋白酶 | 胰 | Tyr,Phe,Trp | Leu,Met,His,Asu,Gln |
| 彈性蛋白酶 | 胰 | Leu,Ile,Ala | 其它等 |
| 胃蛋白酶 | 胃粘膜 | Tyr,Phe,Trp,Met,Len | Ala,Glu,Asp,其它等 |
| 木瓜蛋白酶 | Papayplant木瓜植物 | Arg,Lys,Gly | 其它等 |
| 嗜熱菌蛋白酶 | 嗜熱解蛋白芽孢桿菌 | Leu,Ile,Phe | Val,Tyr |
| 枯草桿菌蛋白酶 | 枯草桿菌 | 芳香族及脂肪族殘基 |
肽鏈的裂解和重組大致有三種情況:一種是非特異性裂解,如酸水解。由于裂解的片段較小,造成分離的困難。因此這種非特異性裂解對大分子肽鏈是不適用的。第二種是特異性裂解,采用兩種以上的專一裂解,然后進行組合,這種方法一般也適用于分子量小于5萬的蛋白質。第三種是逐步的專一裂解,首先將某種氨基酸進行化學修飾,使水解酶專一斷裂某一種氨基酸,分成若干片段,然后解除化學封閉,再用此酶裂解,使曾被封閉過的氨基酸斷裂。目前傾向于采用這種裂解方式。
3.肽段的分離
大部分肽段的分離主要通過凝膠過濾法,由于大分子肽溶解度小。往往采用甲酸、醋酸、丙酸等有機溶劑使之溶解。單用凝膠過濾法分離之肽一般純度不高,常需輔以離子交換層析法,大片段肽可用離子交換葡聚糖作載體,小肽則多用Dowex-50等樹脂。
小肽分離還常采用高壓電泳與層析相結合的指紋圖譜法,得到純凈肽。
4.肽的順序分析
在蛋白質一級結構的測定中,肽的順序分析是比較重要的一步。肽的順序分析也有化學法和酶解法兩種。
1)化學法Edman降解法
這是目前用于順序分析的最主要的方法。它的原理是從N端開始,逐步降解。將肽先與異硫氰酸苯酯(PTH試劑)在pH8-9條件下作用,肽的NH2末端接到異硫氰酸苯酯的C原子上生成苯異硫甲氨酰肽,簡稱PTC肽,在強酸作用下,可使靠近PTC基的氨基酸環化,肽鍵斷裂形成苯氨基噻唑啉酮衍生物和一個失去末端氨基酸的肽鏈。此肽不被破壞,因而又可出現一個的N-末端。重復以上的步驟,繼續與PTH試劑作用,繼續分析,苯氨基噻唑啉酮衍生物很容易由有機溶劑抽提出來進行鑒定。但此衍生物很不穩定,在水中可轉化為穩定的乙內酰苯硫脲氨基酸(PTH-氨基酸)。這些步驟通常稱為Edman氏逐步降解法。所以可用來測定氨基酸的排列順序。Edman降解法的優點是樣品用量少,靈敏度高。
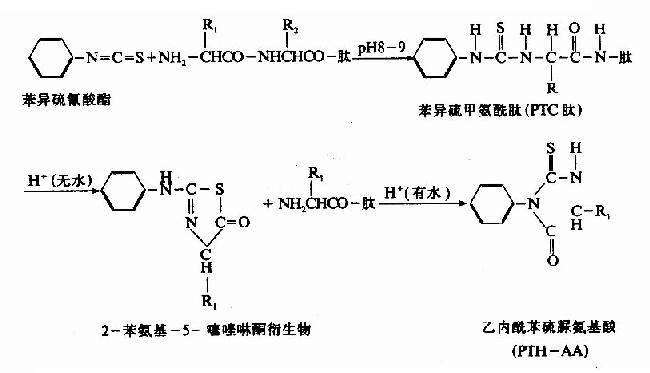
PTH-氨基酸的鑒定可以用各種層析方法,如紙層析、薄層層析、氣相層析和質譜法等,現在多用高壓液相層析法。雖然此方法具有很多優點,但是由于操作繁瑣,工作量大,所以目前有人根據Edman降解的原理作一系列改進。
下面簡單介紹幾種方法
A.1967年Edman及Begg介紹了一種Edman降解的液相自動分析裝置,使順序分析開始走向自動化。將樣品先在反應杯內旋轉成薄膜,使之固定。然后與PITC試劑反應。再用有機溶劑多次抽提除去過剩試劑,因而樣品易丟失,且儀器昂貴,使用受到限制。
B.1970年Laursen改進為固相氨基酸順序儀。此法樣品用量少,檢出靈敏,可分析20?0肽,其原理是將肽共價結合到惰性支持物上,固定后裝柱再行Edman降解。
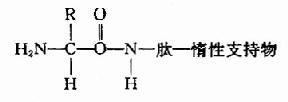
固相順序儀的惰性支持物有:

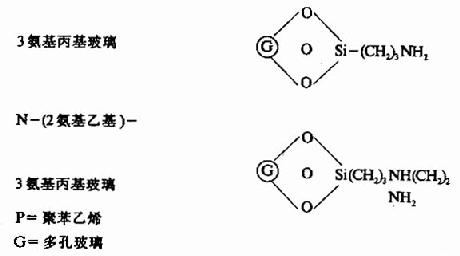
此法成功的關鍵是肽段的固定,目前采用C端α羧基固定法,重復法高,其中以高絲氨酸內酯法及雙異硫氰酯法(DITC)最好,固定率可達90-95%。
C.另外也有從化學反應的角度考慮,試圖改進Edman方法。1976年有人將異硫氰酸苯酯的苯基改變為甲氨偶氮苯,試劑為甲氨偶氨苯異硫氰酸鹽(簡稱DABITC)。這是一種有色試劑,產物DABIH氨基酸呈桔黃色,因此鑒定時無需染色,用肉眼即可分辨。此方法靈敏度很高,一次分析小肽段只要幾個nanomole樣品即可,是目前一種很可取的方法。此外也有人將異硫氰酸酯進行35S標記,使分析樣品更向微量化方向發展。
2)酶解法肽譜重迭法
分析肽段也可采用酶解法,利用專一性不同的兩種酶將一個肽分別斷裂成更小的寡肽,比較兩種方法所得之肽段的重復性,進行氨基酸順序的裝配。例如,有一個肽段,通過氨基酸組成分析已知其為十肽,假如先以糜蛋白酶水解,則得到一套寡肽,再以胰蛋白酶水解此十肽,得到另一套寡肽。分析結果如下:
Ala.Phe+Gly.Lys.Asn.Tyr+Arg.Trp+His.Val
糜蛋白酶水解
+肽(Ala.Phe.Gly.Lys.Asn.Tyr.Arg.Trp.His.Val)
胰蛋白酶水解
Ala.Phe.Gly.Lys+Asa.Tyr.Arg+Trp.His.Val
將此兩套寡肽可以做分析比較,因為十肽的N末端及C末端已事先測定分別為Ala及Val,因此第一段寡肽必然是Ala,Phe。如此類推如下
| 寡肽號 | 氨基酸組成部分順序 |
| A-1 | Ala.Pha |
| B-1 | Ala.Phe.Gly.Lys |
| A-2 | Gly.Lys.Asn.Tyr |
| B-2 | Asn.Tyr.Arg |
| A-3 | Arg.Trp |
| B-3 | Trp.His.Val |
| A-4 | His.Val |
| +肽順序 | Ala.Phe.Gly.Lys.Asn.Tyr.Arg.Trp.His.Val |
水解酶也可運用二肽酶,兩組可用同一種酶水解如第一套肽是A桞,C桪,E桭,G桯……第二套肽水解則先將該肽段N端切去一個末位氨基酸,然后再開始二肽酶斷裂,結果是A,B桟,D桬,F桮……這樣分析比較也可排列出肽段順序。
5.二硫鍵定位
蛋白質分子不經任何處理,直接用酶水解,檢出其中二硫鍵的肽段,然后將二硫鍵拆開,分別測定兩個肽的順序,將此兩肽結構與測出的一級結構比較,就能找出相應的二硫鍵的位置。
含二硫鍵肽的檢出方法。
1)凝膠過濾或離子交換層析:用以分離各肽段,然后用特殊的二硫鍵顯色反應找出含二硫鍵的肽。
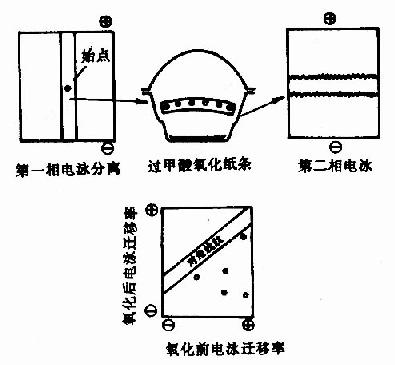
圖1-21 對角線電泳技術圖解
2)對角線電泳或層析:1966年Brown及Hartlay提出用對角線電泳進行含-S-S-肽的定位,此方法是將水解后的肽混合物進行第一相電泳,樣品點在中間,電泳畢,將樣品紙條剪下,置于裝有過甲酸的器皿中,用過甲酸蒸氣處理2小時,使-S-S-斷裂,此時含-S-S-肽段的靜電荷發生了改變。然后將紙條縫于另一張紙上,進行第二相電泳電泳,電泳條件與第一相相同,只是與第一次向成直角。在第二相電泳中,那些不含-S-S-的髣民泳情況與第一相相同,因此電泳后各肽斑均坐落在紙的對角線上,而那些含-S-S-的肽由于被氧化,電荷發生變化,第二相電泳速度就與第一相不同,電泳結果這些肽斑就偏離對角線,肽斑可用茚三酮顯示。對角線法由于其速度快,操作簡便以及能用于小分子樣品,是直接分離-S-S-肽的好方法。
含-S-S-肽被分離后,即可進行肽段順序分析,并與已測定的該蛋白質的一級結構進行比較,即可找出相應的-S-S-位置,至此蛋白質的一級結構基本闡明。
今后蛋白質一級結構的測定正朝自動化、快速化及微量化發展,關鍵問題仍然是進一步尋找蛋白裂解和肽分離的方法。
蛋白質一級結構的測定不斷有新方法和新思路出現,如X衍射法測定一級結構;分離相應蛋白質的mRNA,由mRNA的一級結構排出蛋白質的一級結構等。這些大膽的設想必將有助于蛋白質的一級結構測定,使人們掌握更多的工具和方法去探索生命的奧秘。
| 關于“生物化學與分子生物學/參考:蛋白質一級結構的測定方法”的留言: | |
|
目前暫無留言 | |
| 添加留言 | |